Sauerstoff-Flaschen für Himalaya-Expeditionen
About points...
We associate a certain number of points with each exercise.
When you click an exercise into a collection, this number will be taken as points for the exercise, kind of "by default".
But once the exercise is on the collection, you can edit the number of points for the exercise in the collection independently, without any effect on "points by default" as represented by the number here.
That being said... How many "default points" should you associate with an exercise upon creation?
As with difficulty, there is no straight forward and generally accepted way.
But as a guideline, we tend to give as many points by default as there are mathematical steps to do in the exercise.
Again, very vague... But the number should kind of represent the "work" required.
When you click an exercise into a collection, this number will be taken as points for the exercise, kind of "by default".
But once the exercise is on the collection, you can edit the number of points for the exercise in the collection independently, without any effect on "points by default" as represented by the number here.
That being said... How many "default points" should you associate with an exercise upon creation?
As with difficulty, there is no straight forward and generally accepted way.
But as a guideline, we tend to give as many points by default as there are mathematical steps to do in the exercise.
Again, very vague... But the number should kind of represent the "work" required.
About difficulty...
We associate a certain difficulty with each exercise.
When you click an exercise into a collection, this number will be taken as difficulty for the exercise, kind of "by default".
But once the exercise is on the collection, you can edit its difficulty in the collection independently, without any effect on the "difficulty by default" here.
Why we use chess pieces? Well... we like chess, we like playing around with \(\LaTeX\)-fonts, we wanted symbols that need less space than six stars in a table-column... But in your layouts, you are of course free to indicate the difficulty of the exercise the way you want.
That being said... How "difficult" is an exercise? It depends on many factors, like what was being taught etc.
In physics exercises, we try to follow this pattern:
Level 1 - One formula (one you would find in a reference book) is enough to solve the exercise. Example exercise
Level 2 - Two formulas are needed, it's possible to compute an "in-between" solution, i.e. no algebraic equation needed. Example exercise
Level 3 - "Chain-computations" like on level 2, but 3+ calculations. Still, no equations, i.e. you are not forced to solve it in an algebraic manner. Example exercise
Level 4 - Exercise needs to be solved by algebraic equations, not possible to calculate numerical "in-between" results. Example exercise
Level 5 -
Level 6 -
When you click an exercise into a collection, this number will be taken as difficulty for the exercise, kind of "by default".
But once the exercise is on the collection, you can edit its difficulty in the collection independently, without any effect on the "difficulty by default" here.
Why we use chess pieces? Well... we like chess, we like playing around with \(\LaTeX\)-fonts, we wanted symbols that need less space than six stars in a table-column... But in your layouts, you are of course free to indicate the difficulty of the exercise the way you want.
That being said... How "difficult" is an exercise? It depends on many factors, like what was being taught etc.
In physics exercises, we try to follow this pattern:
Level 1 - One formula (one you would find in a reference book) is enough to solve the exercise. Example exercise
Level 2 - Two formulas are needed, it's possible to compute an "in-between" solution, i.e. no algebraic equation needed. Example exercise
Level 3 - "Chain-computations" like on level 2, but 3+ calculations. Still, no equations, i.e. you are not forced to solve it in an algebraic manner. Example exercise
Level 4 - Exercise needs to be solved by algebraic equations, not possible to calculate numerical "in-between" results. Example exercise
Level 5 -
Level 6 -
Question
Solution
Short
Video
\(\LaTeX\)


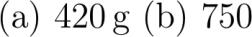
No explanation / solution video to this exercise has yet been created.
Visit our YouTube-Channel to see solutions to other exercises.
Don't forget to subscribe to our channel, like the videos and leave comments!
Visit our YouTube-Channel to see solutions to other exercises.
Don't forget to subscribe to our channel, like the videos and leave comments!
Exercise:
Sauerstoff-Flaschen für Himalaya-Expeditionen stehen gefüllt bei degreeCelsius unter einem Druck von etwa bar. Der Sauerstoff kann aus diesen .liter Flaschen über ein Druckreduktionsventil dosiert herausgelassen werden. Die Dichte von Sauerstoff bei Normdruck beträgt .gramperliter. Wie viele Atemzüge kann der Bergsteiger mit dem Sauerstoff aus der Flasche machen wenn er pro Atemzug die gleiche Menge aus der Flasche entnimmt wie Liter Luft unter Normalbedingung enthalten? Der Sauerstoff-Anteil in der Luft beträgt rund %.
Solution:
Um die Masse in Gramm des Sauerstoffes zu bestimmen müssen wir das Volumen des Sauerstoffs kennen. Wir können aber nicht die in der Aufgabe gegebenen .l nehmen weil die bei bar gelten. Die angegebene Dichte ist aber auf Normdruck also etwa bar bezogen. Also müssen wir als erstes das Volumen des Sauerstoffs bei diesem Normdruck bestimmen: V_ fracp_p_ V_ frac.ePaePa .cubicmeter .cubicmeter Nun ist die Masse schnell bestimmt: m rho V .kilogrampercubicmeter .cubicmeter .kg Zwei Liter Luft mit % Sauerstoffgehalt entsprechen also m . rho V . .kilogrampercubicmeter .cubicmeter .kg Sauerstoff. Man könnte also etwa n fracMm frac.kg.kg Atemzüge davon nehmen.
Sauerstoff-Flaschen für Himalaya-Expeditionen stehen gefüllt bei degreeCelsius unter einem Druck von etwa bar. Der Sauerstoff kann aus diesen .liter Flaschen über ein Druckreduktionsventil dosiert herausgelassen werden. Die Dichte von Sauerstoff bei Normdruck beträgt .gramperliter. Wie viele Atemzüge kann der Bergsteiger mit dem Sauerstoff aus der Flasche machen wenn er pro Atemzug die gleiche Menge aus der Flasche entnimmt wie Liter Luft unter Normalbedingung enthalten? Der Sauerstoff-Anteil in der Luft beträgt rund %.
Solution:
Um die Masse in Gramm des Sauerstoffes zu bestimmen müssen wir das Volumen des Sauerstoffs kennen. Wir können aber nicht die in der Aufgabe gegebenen .l nehmen weil die bei bar gelten. Die angegebene Dichte ist aber auf Normdruck also etwa bar bezogen. Also müssen wir als erstes das Volumen des Sauerstoffs bei diesem Normdruck bestimmen: V_ fracp_p_ V_ frac.ePaePa .cubicmeter .cubicmeter Nun ist die Masse schnell bestimmt: m rho V .kilogrampercubicmeter .cubicmeter .kg Zwei Liter Luft mit % Sauerstoffgehalt entsprechen also m . rho V . .kilogrampercubicmeter .cubicmeter .kg Sauerstoff. Man könnte also etwa n fracMm frac.kg.kg Atemzüge davon nehmen.
Meta Information
Exercise:
Sauerstoff-Flaschen für Himalaya-Expeditionen stehen gefüllt bei degreeCelsius unter einem Druck von etwa bar. Der Sauerstoff kann aus diesen .liter Flaschen über ein Druckreduktionsventil dosiert herausgelassen werden. Die Dichte von Sauerstoff bei Normdruck beträgt .gramperliter. Wie viele Atemzüge kann der Bergsteiger mit dem Sauerstoff aus der Flasche machen wenn er pro Atemzug die gleiche Menge aus der Flasche entnimmt wie Liter Luft unter Normalbedingung enthalten? Der Sauerstoff-Anteil in der Luft beträgt rund %.
Solution:
Um die Masse in Gramm des Sauerstoffes zu bestimmen müssen wir das Volumen des Sauerstoffs kennen. Wir können aber nicht die in der Aufgabe gegebenen .l nehmen weil die bei bar gelten. Die angegebene Dichte ist aber auf Normdruck also etwa bar bezogen. Also müssen wir als erstes das Volumen des Sauerstoffs bei diesem Normdruck bestimmen: V_ fracp_p_ V_ frac.ePaePa .cubicmeter .cubicmeter Nun ist die Masse schnell bestimmt: m rho V .kilogrampercubicmeter .cubicmeter .kg Zwei Liter Luft mit % Sauerstoffgehalt entsprechen also m . rho V . .kilogrampercubicmeter .cubicmeter .kg Sauerstoff. Man könnte also etwa n fracMm frac.kg.kg Atemzüge davon nehmen.
Sauerstoff-Flaschen für Himalaya-Expeditionen stehen gefüllt bei degreeCelsius unter einem Druck von etwa bar. Der Sauerstoff kann aus diesen .liter Flaschen über ein Druckreduktionsventil dosiert herausgelassen werden. Die Dichte von Sauerstoff bei Normdruck beträgt .gramperliter. Wie viele Atemzüge kann der Bergsteiger mit dem Sauerstoff aus der Flasche machen wenn er pro Atemzug die gleiche Menge aus der Flasche entnimmt wie Liter Luft unter Normalbedingung enthalten? Der Sauerstoff-Anteil in der Luft beträgt rund %.
Solution:
Um die Masse in Gramm des Sauerstoffes zu bestimmen müssen wir das Volumen des Sauerstoffs kennen. Wir können aber nicht die in der Aufgabe gegebenen .l nehmen weil die bei bar gelten. Die angegebene Dichte ist aber auf Normdruck also etwa bar bezogen. Also müssen wir als erstes das Volumen des Sauerstoffs bei diesem Normdruck bestimmen: V_ fracp_p_ V_ frac.ePaePa .cubicmeter .cubicmeter Nun ist die Masse schnell bestimmt: m rho V .kilogrampercubicmeter .cubicmeter .kg Zwei Liter Luft mit % Sauerstoffgehalt entsprechen also m . rho V . .kilogrampercubicmeter .cubicmeter .kg Sauerstoff. Man könnte also etwa n fracMm frac.kg.kg Atemzüge davon nehmen.
Contained in these collections:
-
Boyle-Mariotte by uz

